ATAC-seqで組織サンプルを解析
ATAC-seq(Assay for Transposase-Accessible Chromatin)は、クロマチンのオープン領域を特定するために広く用いられる重要な解析手法です。多くの研究分野で使用される手法のため、細胞のみならず、生検組織・凍結組織などをサンプルとして実施されることも多く見られます。
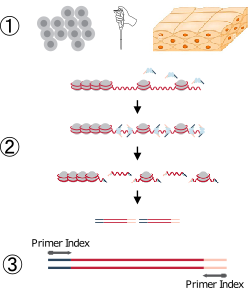
ATAC-seqの手順は3つのステップで構成されており、核の抽出、タグメンテーション、ライブラリーの増幅の3つのステップで構成されていますが、細胞と組織における手順は核抽出のステップにおけるサンプルの処理法に違いが生じます。
組織からの核抽出
核の抽出はATAC-seqではミトコンドリアゲノムDNAのサンプルへの混入を防ぎ、目的のオープンクロマチン領域を多く含むライブラリーを得ることを目的として行われます。
しかしながら、核抽出を行うことは、段階的な分画手順により複雑な細胞小器官や細胞内生体分子の組成が簡素化され、目的の物質の濃縮につながるため、ATAC-seqにとってのみならず、他のChIP-seqやChIPmentationなどの手法においても有用なプロセスです。
組織から核抽出を行う場合、組織サンプルの小切片をLysis bufferで懸濁し、ダウンスホモジナイザーなどで物理的に単一細胞レベルまで分解した後、セルストレーナーで夾雑物を取り除き、核を単離するための単一細胞を回収します。
回収した単一細胞からはいくつかの方法で核を抽出できます。一つは段階的に外側細胞膜だけを可溶化し、核だけを遠心によってペレットとして得る方法です。しかしながら、この方法は他の細胞小器官の混入が否定できません。
もう一つの方法は、細胞膜の可溶化後、密度勾配遠心分離を行い、汚染細胞構造から核を分離させる方法です。無傷の核は、哺乳動物細胞において特有のサイズを有しているため、この手法によって他の細胞小器官から分画し、より純度の高い核を得ることが可能になります。
単離した核は少量分取後、トリパンブルー下で検鏡し、個数や形態を確認することにより品質チェックを行います。抽出した核を界面活性剤で処理することにより、タグメンテーションが可能となり、オープンクロマチン領域のライブラリーを調製することができます。
ATAC-seq package for Tissue

Diagenodeでは、組織サンプルからの核抽出に最適化された抽出試薬に、活性に定評のある高効率Tn5 transposase(loaded Tagmentase)を使用したATAC-seqキット、高リカバリーDNA精製カラムとUDIを組み合わせたATAC-seq package for Tissueをご提供いたします。
ATAC-seq package for Tissueの特徴
-
Tissue Nuclei Extraction for ATAC-seq
哺乳動物の組織からの核抽出に最適化され、密度勾配法によって高品質な核が得られる核抽出試薬です。哺乳動物の様々な部位の組織で検証され、フレッシュな組織、凍結組織両方に適用可能です。
-
定評のある高効率Tagmentase
活性に定評のある高効率Tn5 transposase (loaded Tagmentase)を使用したATAC-seqキットです。最適なPCR増幅サイクル数を実験に応じて決定できるプロトコールです。
-
MicroChIP DiaPure columnを同梱
タグメンテーション後のDNA断片を濃縮・精製する精製カラムをパッケージに同梱しています。簡単な手順で精製度の高いDNAが得られます。
-
UDIデュアルインデックス
Illumina社のシーケンサーでご使用いただけるUDI(ユニークデュアルインデックス)を同梱しています。マルチプレックスでシーケンスする際にIndex hoppingによる影響を排除できます。
25~100 mgの生検・凍結組織からATAC-seqの実験を行っていただくことが可能です。哺乳動物の肺・肝臓・脳・腎臓・筋肉からのATAC-seq用ライブラリー調製で検証され、良好な結果が得られています。
パッケージにはサンプル処理からライブラリー調製までのプロトコールが付属しております。このプロトコールは実際にDiagenodeの受託解析担当スタッフがルーティンで使用しているプロトコールを基に作成されています。
キットについての詳細・実験例はグローバルサイトでご紹介しております。グローバルサイトで是非詳細をご確認ください!