転写因子(てんしゃいんし)はDNAに特異的に結合するタンパク質の一群です。細胞内で遺伝子が生涯を通じて適切な時に正しい量で正しい細胞において確実に発現されるように、転写を制御してオンオフする機能を持っています。
転写因子群は、細胞分裂、細胞増殖、および細胞死を誘導するように経時的に協調して機能します。また、胚発生の間の細胞の移動や組織化、さらにホルモンのような細胞の外部からの信号に応答して誘導的に機能しています。ヒトゲノムには最大2600ものこのような転写因子が存在しています。
これら転写因子は、DNA上のプロモーターやエンハンサーといった転写を制御する領域に相互作用することによって、DNAの遺伝情報をRNAに転写する過程をRNAポリメラーゼと相互作用することによって促進、あるいは逆に抑制する働きを持っています。
ChIP(クロマチン免疫沈降)は、転写因子とDNAをクロスリンクし、目的の転写因子とDNAの複合体を抗体による免疫沈降によって選択的に濃縮することで、転写因子-DNAの相互作用を解析することが可能な実験手法です。
ChIPは細胞内での転写因子とDNAの結合をin vivoに近い形でとらえることが可能です。エピジェネティックな修飾を受けた状態の染色体の特定の場所に、転写因子が実際に存在していることを示すことができます。多くのエピジェネティクス関連論文で、生体組織内のある特定の転写因子と染色体の間の相互作用を解析するためにChIP-qPCRやChIP-seqを用いています。
さらに近年、細胞シグナリングが、エピジェネティックな修飾によって制御されていることを示す研究が多く発表されています。特にヒストン脱アセチル化酵素阻害剤が多発性骨髄腫の増殖抑制や気管支ぜんそくなどの気道炎症に影響することが明らかになってから、関連するシグナル経路にエピジェネティックな作用が働いていることを示すための研究が多くなされています。
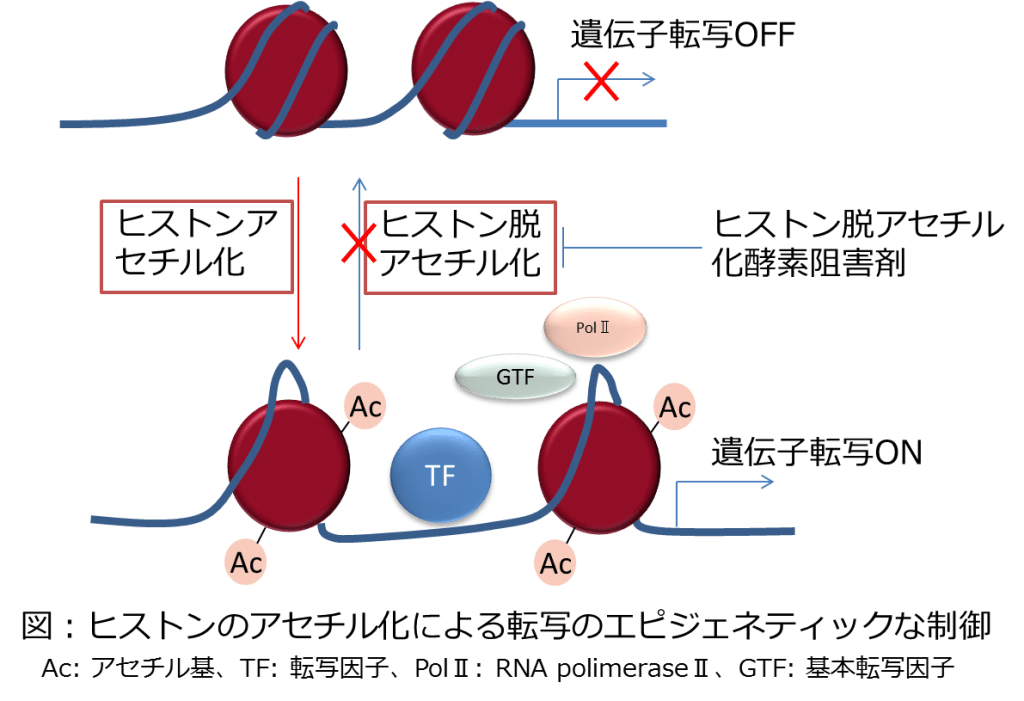
シグナリングファミリーに属する転写因子の相互作用がエピジェネティックな修飾によって変化しているかどうかについての検証にChIP-qPCRおよびChIP-seqを含むChIPアッセイは必須といえます。
しかしながら、転写因子のChIPは比較的難しいと言われています。
ヒストンおよびヒストン修飾はその存在量が比較的豊富であり、染色体DNAに直接結合しているため安定なため、厳しい断片化条件にもうまく対応でき、ChIPも容易です。
それに対し、転写因子はDNAとの相互作用があまり強くないため安定に結合せず、また存在量も豊富ではないため、厳しい断片化条件に対して感受性が高く、十分なサンプル量が得られない可能性が高いのです。
転写コファクターなどの補助因子はDNAとは直接接触しないことも多いため、ChIPにとって最も困難なタンパク質クラスです。ホルムアルデヒドによるクロスリンクの効率が非常に悪く、またDNAをロスする可能性も高いため、厳しい断片化条件に対し最も感受性の高いタンパク質です。
したがって、転写因子のChIPでは、クロスリンク条件も実験の成功のための大事なファクターとなります。
ホルムアルデヒドがクロスリンク可能な距離はわずか2オングストロームであるため、転写因子のDNAに対する配座に応じて異なるクロスリンク剤を検討することは重要です。
また、クロスリンク時間を長くすることも有効な手法です。しかしながら、その場合DNAの回収率が低下する可能性がありますので、クロスリンク剤による処理時間のタイムコースを取り、最適な処理時間の検討を行ってください。適切な処理時間は2~30分、処理終了時にグリシンを加えることによって反応を止めることができます。
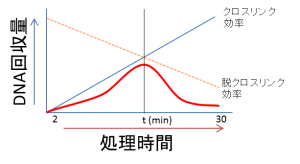
図:クロスリンク時間とDNA回収量との関係(模式図)
DiagenodeのiDeal ChIP-seq for Transcription Factors(C01010055)キットは、転写因子のChIP-seqの結果を安定して得るために最適化されたソリューションです。競合する他社のソリューションとは異なり、本キットの品質は多数の転写因子検証実験によって裏付けられています。
クロスリンク試薬として、ホルムアルデヒドと混合して使用していただける、ChIP Cross-link Gold(Diagenode C01019021)はクロスリンク条件の検討の際に選択していただけます。