エピジェネティクスは後成的なDNAスイッチ
私たちヒトは1個の受精卵から細胞分裂を経て多様な組織や器官に分化していきます。
その際、ゲノムのDNA配列には変化は生じません。DNA配列の変化を伴わず、組織や細胞の種類に応じて異なり、細胞分裂後も継承される遺伝子発現の制御・維持の仕組みのことを、エピジェネティクスと呼びます。
エピジェネティクスは細胞の発生・分化やリプログラミング(iPS細胞など)に深くかかわるのみならず、その経年劣化は老化に、異常化は癌化に深く関与するため、エピジェネティクスはこれらの分野で極めて重要な研究分野となり、すでに診断や治療のバイオマーカーとして応用が始まっています。
エピジェネティック修飾の中で最も代表的なものはDNAメチル化とヒストン修飾です。これらの修飾はヌクレオソームやクロマチンの形成にも影響を及ぼし、より高次のエピジェネティック制御であるヌクレオソームポジショニングを介して、遺伝子の「スイッチ」の役割を果たし、発現の制御に関わっています。

DNAメチル化
細胞はDNAという設計図に従って作られていますが、DNAに従って様々な組織に分化するにはDNA中のどの遺伝子をどのような順番で読みだすかに依存しています。
組織の分化に必要な遺伝子をオンにし、また不必要な遺伝子をオフにする膨大な作業は、DNAに依存しない遺伝子機能制御機構によるものと考えられています。
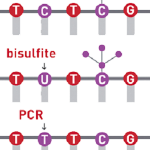
その制御機構の一つとして最もよく研究された分子機構がDNAメチル化です。
遺伝子の転写開始点上流には高頻度にCpG部位が存在する領域があり、 CpGアイランド と呼ばれています。 CpGアイランド のDNAメチル化は転写活性と相関があり、ハウスキーピング遺伝子のような転写活性が高い遺伝子では低メチル化状態に、逆に転写が抑制されている遺伝子では高メチル化状態となっています。
転写因子 (Transcription Factor, TF)はDNAに特異的に結合するタンパク質の一群です。DNA上のプロモーターやエンハンサーといった転写を制御する領域に結合し、DNAの遺伝情報をRNAに転写する過程を促進、あるいは逆に抑制する役目を持っています。
しかし、シトシン塩基がメチル化されたプロモーター領域の転写因子の結合モチーフには、ほとんどの転写因子が結合できなくなります。これはメチル化された部位をメチル化DNA結合タンパク質(Methyl-DNA-Binding、MDBタンパク質)が認識し、結合することによってヒストンメチル化酵素がヒストンをメチル化修飾し、これに結合するその他のタンパク質(ヒストン脱アセチル化酵素HDACやSIRT)がヒストンの凝集を促進し、転写因子のプロモーターへのアクセスを妨げるためと考えられています。
これらのDNAメチル化は哺乳類ではDNMT1、DNMT3a、DNMT3bの3種のDNAメチル化酵素によってDNA複製後も維持・書き込みがなされており、重要なエピジェネティクス上での発現制御の仕組みとして知られています。
DNAメチル化機構によって書き込まれたメチル基は、精子や卵子、胚とヒト成人の組織との間で比較するとそれぞれ場所や数が異なっていることが知られています。メチル化の状態が、ES細胞、iPS細胞の初期化やヒトの老化とも関連していることがよくわかります。
ヒストン修飾とヒストンコード
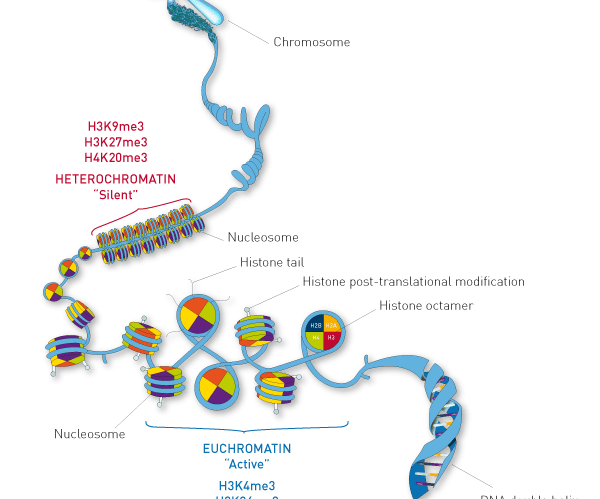
ヒストン は クロマチン を構成する八量体のタンパク質で、それぞれヒストンH2A、H2B、H3およびH4が2つずつ、計8つのタンパクからなっています。染色体はクロマチンによって構成されています。その最小単位はヌクレオソームで、147塩基対のDNAがヒストン八量体のまわりに巻き付く構造によって形成されています。ヌクレオソームはさらに圧縮され、H1および非ヒストンタンパク質によってクロマチン繊維となり、全て合わさって染色体を構成します。

ヒストンのアミノ末端はヒストンテールと呼ばれ、多数のアミノ酸残基がアセチル化、メチル化、リン酸化、ユビキチン化、シトルリン化などの修飾を受けます。これらの修飾の組み合わせは、転写活性やヌクレオソームのゲノム上での位置に影響を及ぼすことが分かっており、こうしたヒストンの翻訳後修飾部位の組み合わせと遺伝子発現への影響のことを「ヒストンコード」仮説とよびます。
ヒストンテールへのエピジェネティック修飾の付加および除去を触媒する多くの酵素が同定されています。メチル化はヒストンメチルトランスフェラーゼ (HMTs) により付加され、ヒストン脱メチル化酵素 (HDMs)により取り除かれます。アセチル化はヒストンアセチルトランスフェラーゼ (HATs) がアセチル基を付加する反応で、 ヒストン脱アセチル化酵素 (HDACs) で取り除かれます。これらの酵素によって修飾のヒストンへの読み・書き・消去が行われています。
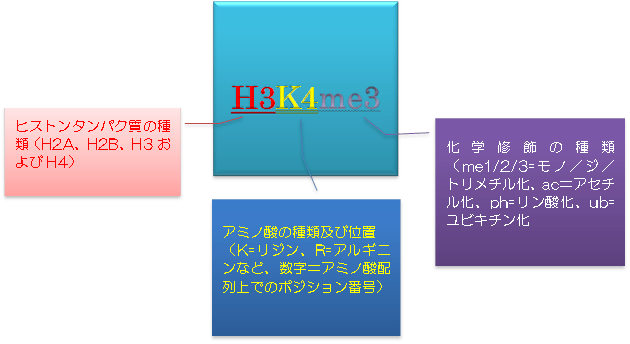
ヒストン修飾 による転写制御の仕組みは複雑で、アセチル化はほぼ全て転写活性化に関与しますが、メチル化は修飾される位置やメチル化の個数(モノ・ジ・トリメチル化)によっても異なります。多様な ヒストン修飾 をコンパクトに表記するため、以下のような表記法が定められています。
ヒストンへのDNAの巻き付いている状態は、これら化学修飾の状態に応じて変化します。状態が変化すればクロマチンリモデリング(再構成)が起き、遺伝子発現もまた変化します。このような翻訳後修飾の役割は酵母・動物・植物でも共通していることが判明しています。
ヒストンの脱アセチル化酵素(HDAT)を阻害することによってDNAの巻き付き方が変化し、巻き付いていないDNA部位へ転写因子が結合可能になることによって、発現が活性化されることが見いだされました。この酵素の阻害薬は、欧米でがん治療に用いられたことから注目され、ヒストン修飾の研究が様々な疾病の治療薬の開発に役立っています。