超音波処理 (49)
【FAQ】アガロースゲルを用いたせん断効率の確認方法
アガロースゲル上で大量のクロマチンが移動すると、実際のDNA断片化を反映しない画質の低下が生じる可能性があるため、ゲルに過負荷をかけないようにします。
切断されたクロマチンからの最適なDNA量は、1レーンあたり約300ngとしてください。100ngから500ngまで希釈系列を作成して最適な濃度を検討することも可能です。
正確な断片化評価のためには、1.2~1.8%アガロースゲル上で剪断されたクロマチンを泳動してください。
また、アガロースゲルで可視化できる最少の剪断クロマチン量は60,000細胞相当に相当します。
【FAQ】超音波処理 (断片化) 条件の最適化
最適化に使用したプロトコルとDiagenodeキットのプロトコルが異なる場合、異なる緩衝液と異なる可能性のあるサンプル量に合わせて、剪断条件(例えば、サイクル数)を再び適応させる必要が生じます。
試料調製と断片化最適化のためには、弊社のChIPキットと同じ緩衝系を含むEasyShearキット(https://www.diagenode.com/en/categories/chromatin-shearing)を推奨しています。
【FAQ】Picoruptor専用チューブについて
Picoruptor消耗品リスト (https://www.diagenode.com/en/categories/bioruptor-pico-accessories) から超音波処理に適していると確認済みの消耗品を選択していただけます。
Picoruptor消耗品は、オートクレーブ処理不可(オートクレーブ処理が超音波処理特性に影響を及ぼす可能性があるため)ですが、日常的にDNAやRNAのワークフローにも使用していただくことが可能な清潔さを有しています。
【FAQ】組織サンプル処理に使用するホモジナイザー
組織によっては、ホモジナイズに異なるアプローチが必要な場合があります。
軟組織(肝臓など)は、ダウンス型ホモジナイザーで十分にホモジナイズできます。
それに対し、硬い組織にはビーズビーティング法などによるホモジナイズの方が適しています。
Diagenodeでは、Picoruptor 2と組み合わせて使用していただけるビーズビーティング用、500μL~2mLまでのサンプルに対応できる専用チューブをご用意しております。
https://www.diagenode.com/jp/p/15-ml-bioruptor-tubes-sonication-beads-50-rxns (Cat. No. C01020031)
【FAQ】細胞破砕時の溶解バッファーに含まれるSDS
SDSは細胞溶解のための膜破砕、タンパク質の可溶化、分解酵素の変性に役立ちます。
SDSを含むバッファーで直接細胞を溶解する1ステップ溶解と、非イオン性洗剤を含むバッファーで細胞膜を溶解した後、分離した核をSDSを含むバッファーで処理する2ステップ溶解が可能です。
二段階の溶解により、可溶性細胞質タンパク質の大部分を除去することができます。これにより、超音波処理の効率が向上し、バックグラウンドの減少やChIPアッセイの感度の向上が期待できます。
細胞数が少ない場合は1ステップ溶解で(詳しくはこちら:Chromatin EasyShear Kit – High SDS)、細胞数が多い場合、長時間固定化した細胞や「難しい」細胞は核分離を伴う2ステップ溶解が適しています(詳しくはこちら:Chromatin EasyShear Kit – Ultra Low SDS, Low SDS and for Plant)。
【FAQ】断片化DNAをさらに短くする?
断片化したクロマチンのフラグメント長分布が大きかった場合、次の2つをお試しください:
・ソニケーションサイクルの回数を増やす
・せん断条件を確認する。サンプル濃度を高くしない、SDSをせん断バッファーに加えることによってせん断効率を劇的に上げられる
以下の記事もご覧ください:
【FAQ】ソニケーターのせん断効率チェックは可能?
【FAQ】ゲノムサイズとソニケーション条件?
超音波処理時間の長さは、細胞の種類、細胞密度、サンプル量、固定時間、せん断バッファー中の界面活性剤の濃度などの要因によって変動します。
したがって、ゲノムサイズに応じてというよりは、新しい実験を開始するごとに常に超音波処理条件を最適化することが重要です。
新しい ChIP プロジェクトを開始するときは、30秒オン/30秒オフの超音波処理サイクルを5、10、15サイクルと振ったタイムコース実験をお勧めします。いくつかの実験条件では、2 ~ 3 サイクルの短い超音波処理時間でも満足のいくクロマチンのせん断が得られる場合があります。ベストプラクティスとして、満足のいくChIP 効率 (最高の回収率/最低のバックグラウンド) が得られる最短の超音波処理時間を選択します。ChIP 実験の効率が低下する可能性があるため、過剰な超音波処理は避けてください。
超音波処理は、新しい細胞の種類ごとに最適化する必要があります。細胞は、それぞれ超音波処理に対する耐性が異なり、一部の細胞株は、他の細胞株よりもクロマチンDNAの剪断が困難です。
「困難な」細胞を扱う場合は、2段階の細胞可溶化ステップ(核分離を含む)をお勧めします。
【FAQ】プローブ型ソニケーターについて
プローブソニケーターはPicoruptorなどが出回る前から広く使用されており、原理的に同じような断片化クロマチンを得ることができます。
しかしながら、実用的にはプローブソニケーターでは超音波の波動がプローブの先端で特に強く、サンプル液中で拡散するとともに伝播が弱くなることなどの欠点もあります。
このことにより、均一な破砕結果が得られない、局所的にサンプル温度が上昇し、そのためにサンプルのエピトープに損傷が生じる、などの事象につながります。
また、プローブソニケーターはサンプルに直接接触するためコンタミネーションリスクもあります。
Picoruptorは水浴を介してチューブ中のサンプルを処理でき、音波の伝播が均一になるよう工夫され再現性のある超音波処理が可能なためお勧めできるソニケーターです。
ChIP-seqに於いてもより再現性のある結果が得られるため、実験成功の確率も増加します。
【FAQ】サイズの大きい断片がNGSライブラリーに混入
ChIPは長い断片がより濃縮される傾向があります。
断片が長いとより多くのエピトープを持っているため、短い断片よりも高い効率で免疫沈降する傾向があります。
この影響を減らすには、効率的な超音波処理を実現して、ほとんどのフラグメントを100〜800 bpの範囲にすることが重要です。
超音波処理の効率を上げるため、クロスリンクを目的のターゲットに最適化し、超音波処理の前に核を分離することによって、超音波処理時のサンプル密度を下げることが有効です。
長い断片が優先的に免疫沈降される現象は、クロマチン量に対し抗体が飽和量になっていない可能性があるため、各免疫沈降時の抗体量に特に注意を払う必要があります。
【FAQ】vehicle投与群は分けて超音波処理する?
原則的にはそうです。細胞間に何らかの違いがあると、超音波処理に対する感受性に影響を与える可能性があります(例: よりコンパクトなクロマチン、細胞生理の変化)。
とは言え、同じ種類のサンプルであれば、処理の有無に関わらず、非常に似たような挙動を示すことが多いようです。
【FAQ】Picoruptorにおける超音波処理条件
超音波処理条件については広範な条件を検討し、最適な効率と再現性が得られる条件を推奨しておりますのでサンプルチューブに対する最適処理サンプル量についても順守されることをお勧めいたします。
従って、130 μLのサンプルはDiagenode 1.5 mLチューブをご使用ください。
チューブの素材・形状・水浴への浸漬度・サンプルの体積・バッファー組成、その他いくつかのパラメーターが断片化の処理結果に影響を及ぼします。
Picoruptor DNA断片化ガイドはこちら(グローバルサイトにリンクします)
Chromatin EasyShear Kitのご案内はこちら(グローバルサイトにリンクします)
【FAQ】転写因子ChIP時の添加SDS濃度
転写因子の解析用にサンプルを処理する際、1% SDSは濃度として高すぎて転写因子の変性やクロマチンからの脱離を引き起こす可能性があります。
Diagenodeでは転写因子のChIPには通常0.2% SDSを使用しており、この濃度であれば影響が最小でかつその後の抗体とのインキュベーションにも支障がありません。
0.2% SDSバッファーは弊社のChIPキットiDeal ChIP-seq kit for TFとEasyShear kit – Low SDSにも同梱され、使用されています。
【FAQ】超音波処理時のサンプルチューブの違いについて
ソニケーション効率はチューブの種類とサンプルの体積に依存して変動します。
Diagenode純正0.65 mLチューブと純正1.5 mL microtubes with capsでは同等のソニケーション効率を示しますが、15 mLチューブでは同等のフラグメント分布を得る場合、より長い時間のソニケーションが必要です。
Diagenode 0.2 mLチューブは最もスループットの高い選択肢でソニケーション時間も若干短くできますが、処理できるサンプルの体積は20-100μL/tubeに限定されます。
チューブ当たりのサンプルの体積は、ソニケーション効率を保ち再現性を維持するためにも守ってください。
また、サンプルの体積の減少に従い断片化効率は上昇します。もし100μLと300μLのサンプルがあり、同じ量の音波エネルギーが印加された場合、100μLのサンプルのほうが効率よく断片化されます。
Picoruptor サンプルチューブラインアップ (pdf書類)
【FAQ】ソニケーションに汎用ラボチューブは使える?
多くの汎用チューブは柔らかい素材で製造されており、発振音波を吸収してサンプルへのエネルギーの伝達を妨げてしまうため、超音波処理には不向きです。
ソニケーション効率はチューブの材質、チューブ壁の厚み、ソニケーション水浴中のサンプルの位置に影響されます。
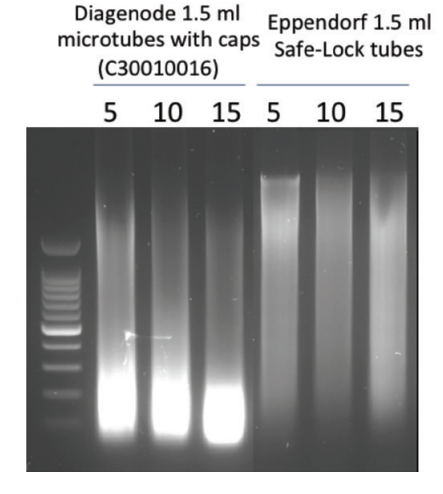
Fig. 汎用チューブとダイアジェノードソニケーションチューブを用いた場合のソニケーション効率の違い
HeLa細胞をホルムアルデヒドで固定化した後、Diagenode Chromatin EasyShear Kit – Low SDS (Cat. No. C01020010)を用いてクロマチンを調製した。サンプルを1.5mL Diagenode microtubes with caps (Cat. No. C30010016)および1.5 ml Eppendorf Safe-Lock tubes中で30秒on/30秒offパターンを5, 10, 15サイクルソニケーション処理を行った。100 bpラダーをサイズマーカーとして同時に泳動した。
【FAQ】ソニケーション時のサンプル温度
ソニケーションの実施温度は4℃が最適です。
サンプルをソニケーションの10分前から氷上で冷やすことにより、核の可溶化とソニケーションの再現性を向上させることが可能です。
【FAQ】超音波処理をサンプルにかけすぎた場合
私たちの経験から、クロマチンDNAを過度に断片化した場合、得られる沈殿が少ない現象が見られるようです。
これは対象エピトープが損傷したり損失が生じたことに起因すると考えられ、特に転写因子が対象の場合に免疫沈降後の沈殿収率に影響を及ぼし、ChIP-seq実験の成否を左右する場合が多いです。
【FAQ】ChIP-MSにおけるソニケーション条件
ChIP-MSはクロマチン関連タンパク質や転写因子/共役因子をタンパク質/タンパク質とタンパク質/DNA間で架橋し、免疫沈降した後に質量分析によって標的のタンパク質と相互作用因子を同定する手法です。
その際のソニケーション条件ですが、タンパク質を損傷しないような条件を維持する上で、サンプルの種類・量・体積に応じた個別の条件を設定する必要が常に生じます。
従って、サイクル数を振って最適なソニケーション条件をご検討ください。
また、サイクル数が多すぎるとタンパク質がクロマチンから解離する場合があります。他方で一部のタンパク質は、他のタンパク質と比べて超音波処理に耐性な場合もあります。
このため、超音波処理の検討時に、目的のタンパク質に対するWestern Blotを実施することもお勧めします。
【FAQ】異なるソニケーター間での性能の違い
全てのソニケーターは異なる性能を持っており、また使用する消耗品やサンプルの種類・体積によってパフォーマンスが変わります。
一例として挙げるとすれば、Picoruptorは前モデルであるBioruptor Plusより約2倍早くクロマチンを断片化することが可能です。
同じモデルの2台のソニケーター間であれば、パラメーターを統一した場合の処理結果はほぼ一致し、よい再現性が得られます。
【FAQ】超音波処理の影響について
DNAを小さい断片にすることの不利な点は、主に長時間のソニケーションに伴いエピトープがダメージを受ける、あるいは除去されてしまうことが主であると考えられます。
また、断片が小さすぎることにより、PCRのかかる断片が少なくなる点も挙げられます。
神経膠芽腫由来ニューロスフェアからのクロマチン調製にはどのような手順が推奨されますか?これまでのところ、ChIPキット添付の可溶化バッファーを使用しても、十分に可溶化した細胞は得られませんでした。
【FAQ】ニューロスフェアのChIPについて
組織または弾力性のある細胞タイプの場合、高品質のクロマチンを得るために多段階の可溶化・ホモジナイゼーションステップが重要です。可溶化・せん断バッファーの組成、サンプルの濃度、およびその他のパラメーターが、最終的なChIPのパフォーマンスに影響を与えます。
(様々な細胞由来のニューロスフェアを使用している論文を参考までご紹介します)
EHM, Oliver, et al. RBPJκ-dependent signaling is essential for long-term maintenance of neural stem cells in the adult hippocampus. Journal of Neuroscience, 2010, 30.41: 13794-13807.
https://www.jneurosci.org/content/30/41/13794.full
NARUSE, Chie, et al. Heterochromatin protein 1γ deficiency decreases histone H3K27 methylation in mouse neurosphere neuronal genes. The FASEB Journal, 2020, 34.3: 3956-3968.
https://faseb.onlinelibrary.wiley.com/doi/full/10.1096/fj.201900139R
GALLAGHER, Denis, et al. Ankrd11 is a chromatin regulator involved in autism that is essential for neural development. Developmental cell, 2015, 32.1: 31-42.
Supplemental Materials
https://ars.els-cdn.com/content/image/1-s2.0-S1534580714007709-mmc1.pdf
【FAQ】ChIPに使用するサンプルの凍結法
まずクロマチン断片化とChIPで最適な結果を得るためには凍結させず新鮮なサンプルを用いるのがベストです。密でコンスタントな断片の分布が得られ、効率的・特異的な免疫沈降の結果が得られます。
もしサンプルの凍結が避けられないときは以下のタイミングで行ってください。
組織:処理した組織の採取直後、あるいはクロマチン断片化後
培養細胞/単離細胞:細胞のクロスリンク後、クロマチン断片化前、あるいは断片化後
以下のQ&Aもご確認ください。
Q. ChIP実験を後で行うため、クロマチンを保存したいのですが、細胞・組織サンプルはどのように保存すればよいですか?
Q. 超音波処理後のクロマチンは凍結保存できますか?凍結保存する場合、凍結前にプロテアーゼ阻害剤を加える必要はありますか?
Q. 超音波処理後のクロマチンを冷凍保存する際、液体窒素で急速冷凍したほうが良いですか?それとも-80℃に保存するだけでよいですか?
Q. 事前にクロスリンク(固定化)・冷凍した細胞をソニケーションテストに用い、実際の実験を新鮮な細胞を使用しても良いですか?冷凍した細胞と新鮮な細胞で断片化の条件は変化しますか?
Q. 細胞サンプルの凍結は-80℃が良いですか?-20℃での凍結でも大丈夫ですか?
【FAQ】クロマチン調製でソニケーションのサイクル数を減らしたい
下に挙げるケースでは、ソニケーションサイクルを多く費やす必要が生じます。
・サンプル濃度が高すぎる場合
・Picoruptorチューブが推奨品でない場合(チューブの材質が柔らかいプラスチックの場合、サンプルを超音波から保護してしまう)
・クロスリンク(固定化処理)が強すぎる(1%ホルムアミド、8~10分で通常のChIPターゲットの場合充分です)
・断片化バッファーにSDSが入っていない
・Triton-Xが断片化バッファーに含まれており、SDSの効果を打ち消している
これらの状況を解消し、改善することによって、ソニケーションサイクルを減らすことができる場合がありますのでご検討ください。
【FAQ】アガロースゲルとBioAnalyzerどちらが最適か
より明瞭な断片化の評価には、1.2~1.8%アガロースゲルに断片化クロマチンをロードして泳動してください。最適なクロマチン量は300 ng/laneです。濃度を100 ngから500 ngまで振って泳動することも可能です。ロード量を増やすと泳動像に影響し、真のDNA断片化状況を反映しなくなるためご注意ください。泳動像から視覚的に確認できる最小の断片化クロマチン量はおよそ60000個の細胞から得られるクロマチン量と同等です。
BioAnalyzerやTapeStationのようなマイクロ流路デバイスがNGSライブラリー調製前のDNA断片のサイズ評価に広く使用されていますが、断片化クロマチンの評価には不向きです。
例えば、アガロースゲルとBioAnalyzerの結果の間で結果の不一致が報告されていますが、これはマイクロ流路デバイスがサンプル中に含まれる残留不純物(イオン、SDS、タンパク質、DNA共沈剤など)や過剰なサンプルロード量、DNAの高次構造などに対し影響を受けやすいことに起因していると言われています。
さらに、BioAnalyzerのトレースは対数軸上にプロットされているため、高分子側のトレースが低分子のトレースと比べて小さい面積上に表示されることから、断片分布状況が視覚的に誤解されやすい点も指摘されます。
また、ピークの表示がモル数の表示である場合、低分子側に多くの分子数が分布することになり、高いピークが表示されることになります。
したがって、マイクロ流路デバイスの結果を見る場合は何を評価しているか、不純物の影響のリスクなどを考慮に入れて解釈する必要があります。
下のリンクでご紹介している質問もご覧ください。
【FAQ】Lysis BufferのSDS濃度について
SDSは1%までの濃度で添加することによってソニケーション効率を向上させることができます。しかしながら、添加することによりターゲットタンパク質が変性したり、高次構造を解離させるリスクも増大します。
従って、実験条件やターゲットの種類に合わせたSDSの最小濃度を決めて実験することが大事です。
他の界面活性剤はSDSのソニケーション効率向上の効果を打ち消す場合があるため、可溶化バッファーやソニケーションバッファーの組成にはバランスを考慮する必要があります。
ダイアジェノードのEasyShear kitやChIP kitでは、ChIPのターゲットに応じて、SDS量を最適化したバッファーを使用していただけます。
- – <0.1% SDS:ヒストンのChIP用
- – 0.2% SDS:転写因子のChIP用
- – <0.5% SDS:植物のChIP用
- – 1% SDS:低インプットのChIP用 (ワンステップ可溶化、収率極大化)
また、SDSの濃度を変えた場合の検証済みの断片化プロトコールについてもご用意しています。詳しくは下のURLをご覧ください。
https://www.diagenode.com/jp/categories/chromatin-shearing(グローバルサイトにリンクします)
【FAQ】冷凍固定化細胞のソニケーション
ChIPに使用する断片化クロマチンの調製には新鮮な細胞をサンプルとしてソニケーションを行い、実験に即使用するのが最も適しています。
しかしながら、凍結細胞をソニケーションして断片化することも可能です。
冷凍した細胞ペレットは、冷凍したソニケーション済みクロマチンサンプルより安定に保存できます(新鮮細胞>冷凍細胞≫冷凍クロマチン)。
冷凍細胞は新鮮細胞とは異なる挙動を示す場合があるため、それぞれ個別にソニケーション条件を最適化することを推奨します。
最適な結果を得るために、ダイアジェノードでは冷凍した細胞より新鮮細胞を使用することを強くお勧めしています。
【FAQ】最適な超音波サイクル数の決定方法
理想的には別々のサンプルを使用し、サイクル毎に個別に検討するのが条件最適化には最良ですが、様々な断片化条件の同一チューブから断片化状況の測定のために少量採取する方法も良く使用されます。
この方法の場合、サンプルの体積や濃度が変わり、これらは少しの変化でも断片化効率に強い影響があるため、後の実験において再現性が損なわれる可能性があることにご注意ください。
【FAQ】クロマチンが断片化しない
クロマチン断片化への固定化時間の影響は、固定化時間あたりの超音波処理効率によって反映されます。
固定化時間が長いと、分子量が大きく、超音波耐性(10分以上の超音波処理でも断片化しない場合もある)の断片が増加します。
また、異なる種類のサンプルはホルムアルデヒドによる固定化に対して異なる挙動を示します。
したがって、実験に使用する各サンプルに対し、それぞれ個別に最適な固定化時間を決定してください。
転写因子や、間接的に結合しているターゲットを分析する場合は、固定化時間を長くする必要があります。
【FAQ】大きい転写因子のChIPについて
超音波処理によって400bpよりも小さいサイズにクロマチンを断片化する場合(特にChIP-seqで使用する場合)、大きな分子量のタンパク質を分解してしまうことがあります。
タンパク質の分解はChIP効率を下げるため、ソニケーションの強度は必要最低限とし、フラグメントのサイズ(800bp以下)とタンパク質のエピトープ保護をバランス良く両立できるように調整してください。
【FAQ】断片化クロマチンの冷凍保存
クロマチンは断片化バッファー内で直接-20℃で保存可能です。
急速冷凍は必要ないばかりか、エピトープの保護に支障がある場合があります。
理想的には冷凍を避けて直接実験に使用することが望ましいです。
【FAQ】ソニケーション時のSDS濃度
SDSの添加により、ソニケーション効率を向上し、クロマチンの収率、エピトープの保存性も高めることができます。
しかしながら、SDS濃度が高いとDNAに直接結合しないタンパク質同士の相互作用を損なう可能性や、変性に弱いエピトープを失って抗体結合に影響を与える可能性が生じます。
SDS濃度については実験のターゲット毎に必要性を検討し、量を調整することが必要です。
下のリンクでご紹介している質問もご覧ください。
【FAQ】ソニケーション間のインターバルについて
ソニケーション間のインターバルは断片化効率や再現性、エピトープの保存性を左右します。
ソニケーションサイクル間でサンプルが十分に冷却されていることが大切だからです。
組織に限らず、細胞などすべてのサンプルで処理中のサンプルの冷却維持に努めてください。
【FAQ】酵母細胞のソニケーション
超音波処理(ソニケーション)時間は、細胞株ごとおよび生物ごとに異なります。
さらに、架橋時間と試薬の種類も超音波処理(ソニケーション)効率に影響を与えます。
従って、予備実験として超音波処理(ソニケーション)時間を振って最適なせん断条件を検討することが必要になる場合があります。
理想的には、満足のいく結果が得られる時間経過条件のうち、最小時間で処理することが望ましいです。
【FAQ】ChIP断片化バッファーについて
Diagenodeでは最適なクロマチン調製のために様々に最適化された製品をご用意しております。
Chromatin EasyShear KitsとPicoruptorを共に使用することで、抗体が作用するエピトープに影響を与えることなく、効率的に細胞の破砕とクロマチンの断片化を行うことが可能です。
各Chromatin EasyShear Kitはサンプルや実験目的ごとに最適化された試薬と検証済みのプロトコールを提供しています。
SDS濃度についてはターゲット毎の要求に応じたワークフローに合わせて選択できます。
DiagenodeのChromatin EasyShear Kitsはクロマチン断片化実験の処理条件最適化に最適にご使用いただけます。
【FAQ】ソニケーションビーズの使用について
ソニケーションビーズは特殊な用途、特殊なチューブのセットアップと組み合わせて使用していただけます。
例えばPicoruptorを用いたクロマチンの断片化を15mLチューブ中で行う場合は、ソニケーションビーズを加えて処理するのが最適です。
サンプル量が少ない場合、ビーズを入れる必要はなく、そのまま処理することで標準的な量の断片化クロマチンが得られます。
ビーズを用いたソニケーション処理は主にタンパク質やRNAの抽出に使用していただけます。
【FAQ】ソニケーションビーズの量について
終体積2 mLのサンプルを処理する場合、15 mLのPicoruptorチューブに0.3 mLの線までソニケーションビーズを入れてください。これは約800 mgの重量となります。
【FAQ】ChIPでMegaruptor?
Megaruptorで使用している技術についてはクロスリンクなどの固定化作業をしていないDNAやRNAの使用を前提にしていますので、理論的にはクロスリンクされたフラグメントにも使用可能とは考えられるものの追加で最適化が必要になると思われます。
また、ChIP実験においてもそのような大きなフラグメントの使用はバックグラウンドシグナルが高くなる恐れがあるため推奨しておりません。
参考までに、Picoruptorで安定して得られるフラグメントの鎖長範囲は100-800 bpです。その範囲内での実験もご検討ください。
【FAQ】結合領域の狭いタンパク質のChIPについて
このような場合でも、200-500 bpの鎖長範囲のフラグメントがChIP-seqで最もシャープなピークを生成するため、200-500 bpの鎖長範囲を濃縮できるよう調整してください。
また、短いフラグメントはqPCRで検出されないリスクもあります。
短いフラグメントを生成するために、ソニケーションサイクルを増加する必要がありますが、そのような場合エピトープの構造が損なわれるリスクについても考慮が必要です。
【FAQ】ソニケーション用チューブについて
効率的なソニケーション効果を得るうえで、推奨された消耗品を使用すること、サンプルの体積を検証済みの体積で処理することは大変重要です。
チューブの形状や素材、体積を変更する場合、ソニケーションのパラメーターを変更し、改めて最適化する必要があります。
不適切な消耗品(不適切な素材)の場合、サンプルが完全に超音波エネルギーから遮断されてしまい、せん断が行われない場合があります。
【FAQ】サンプル溶液中の泡と超音波効率
サンプル溶液中の泡については、サンプル周囲の泡によりサンプルへの超音波エネルギーの伝達が遮断されるため、溶液が強く発泡している状態は避けることが望ましいです。
スピンダウンを行う、またはせん断バッファーの界面活性剤濃度を減らして泡が生じないように断片化作業(ソニケーション)を行ってください。
【FAQ】ソニケーター水浴水の水温について
実際にソニケーションを開始する前に水浴を4℃にしておくことはサンプルを保護し、最適な効率と再現性で断片化を行う上で非常に重要ですので、必ず事前に4℃の水浴を準備してください。
【FAQ】ChIPのバッファー調製方法について
高品質なクロマチンの調製は複雑なプロセスを含むため、バッファー調製にも多くの最適化が必要です。
Diagenodeでは実験の最適化に役立ち、ChIP前に効率よくクロマチン調製を行っていただけるChromatin EasyShear Kitsをご用意しています。
実験対象やサンプルのタイプに応じて、バッファー組成・SDS濃度・プロトコールがクロマチン調製に最適化されています。
Chromatin EasyShear Kitsを用いたクロマチン調製の最適化法についての詳細はこちらをご覧ください。
【FAQ】酵素法によるクロマチン調製について
酵素法でChIPに最適な長さのクロマチンDNAの断片長を得るためには、ヌクレアーゼ濃度と反応時間の最適化を行う必要があります。
酵素法のプロトコールは以前は頻繁に使用されていましたが、酵素の使用に起因する再現性とバイアスの問題を避けることは困難です。
確かに酵素法は穏和な条件でエピトープを損なう可能性が低くChIPに適していますが、次世代シーケンスで網羅的に配列解読した際に、シーケンス結果にバイアスを生じる可能性があるためです。
従って、クロマチンDNAの断片化方法としては、ソニケーションをお勧めします。
【FAQ】ソニケーションパターンの確認について
同じプロセスを繰り返し行っている際でも、処理したクロマチンのバッチ毎に確認し、実験の前の基礎資料とすることを推奨します。
クロマチンのフラグメントサイズの検定前には必ず脱クロスリンクとRNase処理を行い、DNAを精製してください。
脱クロスリンクを行わない場合、泳動速度が変化してしまうため正確なフラグメントサイズの検定は行えません。
また、RNAが残存していると低分子側にRNAがバックグラウンドとして検出されるため低分子の断片の検出に影響を及ぼします。
【FAQ】ソニケーション前の細胞の再懸濁について
100~300万個・細胞あたりShearing buffer 100μLが通常最適な体積です。
ただし、使用される細胞の種類によって最適な体積は変動します。
【FAQ】クロマチンの凍結保存について
Shearing buffer中のクロマチンは少なくとも数週間は-20℃で凍結保存することが可能です。
しかしながら、超音波処理(ソニケーション)後ただちに使用したほうが最適な結果が得られます。
また、プロテアーゼ阻害剤について、可溶化した細胞を扱う際はプロトコール全般にわたって使用することをお勧めします。
したがって、クロマチンの保存バッファーにもプロテアーゼ阻害剤を加えてください。
【FAQ】ソニケーション時のサンプルホルダーについて
サンプルホルダーに等量の水を入れたチューブをブランクとして全てのポジションに入れることをお勧めします。これは、音波の反射や干渉が処理ごとに変化するのを防ぐためです。
【FAQ】SDSの析出を防ぐ方法について
Shearing bufferは超音波処理のなるべく直前にサンプルに添加する必要がありますが、最適な結果を得るためには、超音波処理前に氷上で10〜15分間インキュベートします。
超音波処理は通常数分しかかかりません(超音波処理装置とサンプルタイプによって異なります)。
超音波処理時間を短くすることにより、SDSの実質的な沈殿を防ぎます。
プロセス中にSDSのごく一部が沈殿する場合であれば、これは通常害となる影響は与えません。
【FAQ】ChIPに使用する典型的なソニケーションサイクル
必要な超音波処理(ソニケーション)のサイクル数とトータルの超音波処理(ソニケーション)時間は必要とするDNA断片の長さによって異なります。推奨プロトコールを以下にご提供します。
実際のソニケーション結果は細胞の種類と初発サンプル量、純度、体積、濃度及びサンプルの粘性に応じて変動します。
1サイクルあたり30秒ON/30秒OFFとし、ご使用になるサンプルに対しサイクル数のタイムコースを取って最適なせん断条件の評価を行うことを推奨します。
Chromatin shearing optimization kit – Low SDSを用いた新鮮組織および冷凍組織からの断片化クロマチン調製の最適化検討
Chromatin shearing optimization kit (Universal Plant ChIP-seq kit)を用いた植物組織からの断片化クロマチン調製の最適化
Picoruptor専用0.1、0.65、1.5 mLサンプルチューブを用いた10-300μLクロマチンの断片化
Picoruptor専用15 mLサンプルチューブを用いた0.5-2 mLクロマチンの断片化
Picoruptor専用0.2 mLサンプルチューブを用いたクロマチン断片化の再現性検討
Picoruptorを用いたChIP脱クロスリンク後のDNAの再断片化





